SCIENCE & TECHNOLOGY
Nuestra experiencia en I+D
Una nueva perspectiva en el desarrollo de biosimilares
La innovación continua y la optimización avanzada de la plataforma nos han permitido aumentar la velocidad de ofrecer medicamentos.
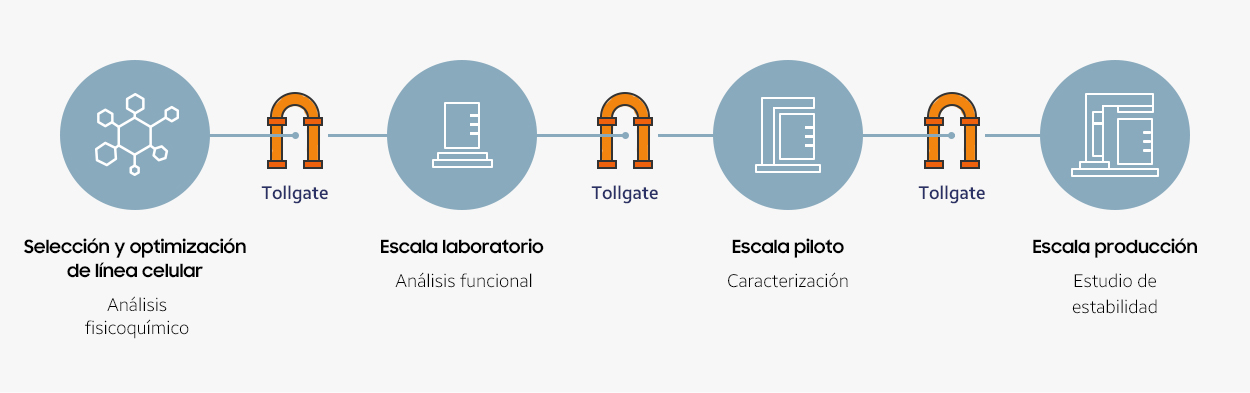
El modelado y la simulación de procesos para el escalado
de la fabricación es una parte importante del desarrollo de biosimilares, donde se requiere un estricto control de calidad. Incluso un pequeño cambio en la temperatura o en otras condiciones de cultivo celular puede afectar a la calidad de los biosimilares durante el escalado del laboratorio al mercado. En Samsung Bioepis hemos establecido una sólida plataforma de escalado basada en varias simulaciones por ordenador y experimentos exhaustivos. Durante la fase de desarrollo, nuestro comité interno de revisión evalúa la calidad de los biosimilares en cada etapa de su desarrollo. Para la producción comercial, controlamos de cerca la calidad de los biosimilares dentro de unos estándares estrictos para reducir las variaciones entre lotes.
Método analítico preciso
A la hora de desarrollar biosimilares, es importante que comprendamos todos los aspectos científicos clave del medicamento de referencia, por lo que analizamos sus características desde diversos ángulos y empleamos hasta 80 métodos para ello. Tenemos que entender cómo reacciona el medicamento desde el punto de vista biológico y fisicoquímico cuando entra en el cuerpo humano y cómo funciona cuando identifica las células diana. Dado que los productos biológicos se fabrican a partir de células vivas, es natural que presenten pequeñas variaciones de un lote a otro. Para conocer a fondo el medicamento de referencia, que puede presentar variaciones de un lote a otro, nos abastecemos de una gran cantidad del medicamento de referencia.
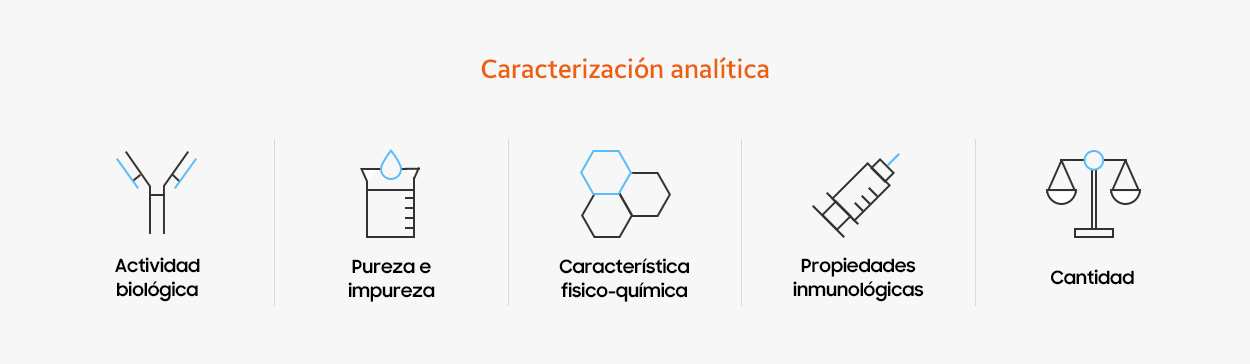
- Biological activity
- Purity and impurity
- Physicochemical properties
- immunological properties
- quantity
- Samsung bioepis - 1st
- Competitor A - 2nd
- Competitor B - 3nd
- Competitor C - 4nd
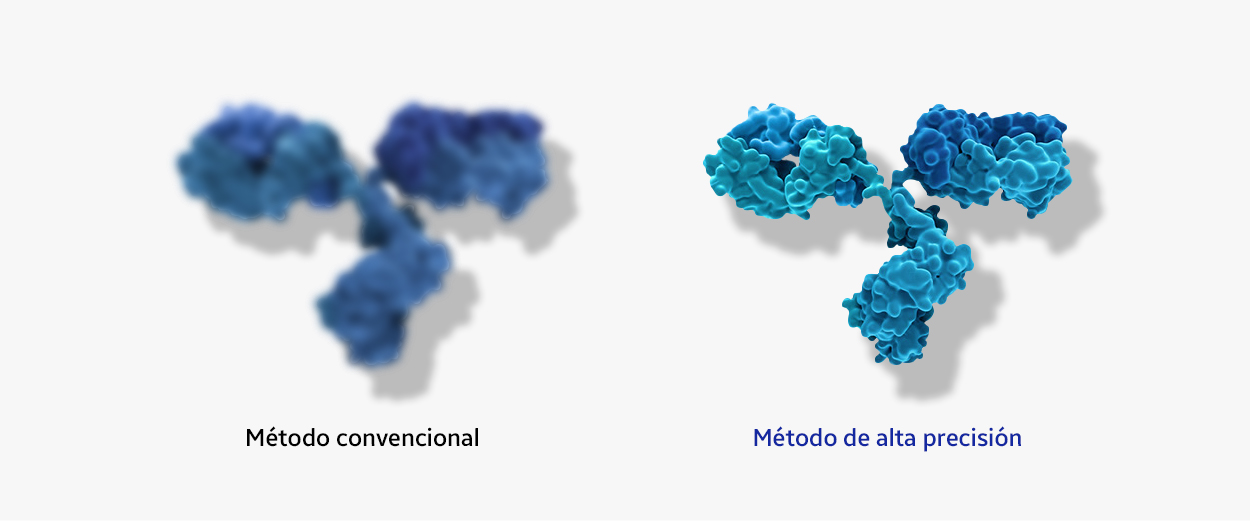
Utilizamos tecnologías de vanguardia para evaluar los atributos críticos de calidad (CQA, por sus siglas en inglés, Critical Quality Attributes).
Desarrollo de medicamentos para satisfacer necesidades no cubiertas.
La seguridad y la comodidad de las personas constituyen el núcleo de nuestro desarrollo de biosimilares. Basándonos en nuestro profundo conocimiento de las necesidades de las personas, nos esforzamos por encontrar formas innovadoras de mejorar su comodidad y de garantizar su seguridad.
La página web de Samsung Bioepis a la que intentas acceder está destinada a residentes en España. y conforme a la normativa vigente en España Por lo tanto, si accedes desde fuera de España, puede contener información sobre medicamentos que aún no están aprobados en tu país o región. Quieres seguir usando el sitio de Samsung Bioepis?