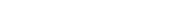SCIENCE & TECHNOLOGY
La nostra esperienza in Ricerca e Sviluppo
Una nuova prospettiva sullo sviluppo dei biosimilari
L'innovazione continua e l'ottimizzazione avanzata della piattaforma ci hanno permesso di aumentare la velocità di produzione dei farmaci e di alzare l'asticella in termini di qualità e fornitura dei medicinali, pur attuando un rigoroso controllo della qualità.
Modellazione e simulazione di processo per la produzione
La produzione su larga scala è una parte importante dello sviluppo dei biosimilari, in cui è necessario un rigoroso controllo di qualità. Anche una piccola variazione della temperatura o di altre condizioni della coltura cellulare può influire sulla qualità dei biosimilari durante il passaggio dalla produzione su piccola scala in laboratorio alla produzione commerciale su larga scala. Noi di Samsung Bioepis abbiamo creato una solida piattaforma di produzione su larga scala basata su molteplici simulazioni al computer e su esperimenti approfonditi. Durante la fase di sviluppo, il nostro comitato di revisione interno valuta la qualità dei biosimilari in ogni fase. Durante la produzione commerciale, monitoriamo attentamente la qualità del biosimilare rispetto a rigorosi standard per ridurre le variazioni presenti tra un lotto e l'altro.
Un metodo analitico preciso
Nello sviluppo dei biosimilari, è importante comprendere tutti gli aspetti scientifici chiave del farmaco di riferimento quindi analizziamo le sue caratteristiche da più punti di vista, utilizzando fino a 80 metodi. Dobbiamo comprendere in che modo il farmaco reagisce dal punto di vista biologico e fisico-chimico quando entra nel corpo umano e come funziona quando identifica le cellule bersaglio. Poiché i farmaci biologici sono prodotti a partire da cellule viventi, presentano naturalmente piccole variazioni tra un lotto e l'altro. Per comprendere a fondo il farmaco di riferimento, che può presentare variazioni da lotto a lotto, ci riforniamo di tale prodotto in grande quantità.
- Biological activity
- Purity and impurity
- Physicochemical properties
- immunological properties
- quantity
- Samsung bioepis - 1st
- Competitor A - 2nd
- Competitor B - 3nd
- Competitor C - 4nd
Utilizziamo tecnologie all'avanguardia per valutare gli Attributi Critici di Qualità (Critical Quality Attributes, CQA).
Sviluppare farmaci per facilitare il raggiungimento degli obiettivi insoddisfatti.
La sicurezza e la convenienza per il paziente sono al centro del nostro sviluppo dei biosimilari Sulla base della nostra profonda comprensione delle esigenze dei pazienti, andiamo alla ricerca di modalità innovative per migliorare la convenienza per i pazienti, garantendo al contempo la sicurezza.
Quality by design e gestione del rischio
Attraverso l'uso del Quality By Design (QbD) creiamo innovazione nei nostri sistemi di produzione. Si tratta di un approccio sistematico in cui il processo di sviluppo del biosimilare è progettato con obiettivi pre-determinati sulla base di una valutazione del rischio. Per stabilire gli obiettivi di qualità si procede a un'analisi rigorosa del farmaco di riferimento, in modo che possano essere determinati gli Attributi Critici di Qualità (CQA), ovvero le caratteristiche che determinano la qualità di un biosimilare. Failure Mode Effects Analysis (FMEA) è un approccio alla gestione del rischio basato su pianificazione degli scenari e simulazioni. Sulla base delle conoscenze acquisite in precedenti progetti di sviluppo, abbiamo realizzato una solida strategia di minimizzazione che ci permette di pianificare i possibili rischi e di ridurre al minimo gli errori in ogni fase del processo di sviluppo.
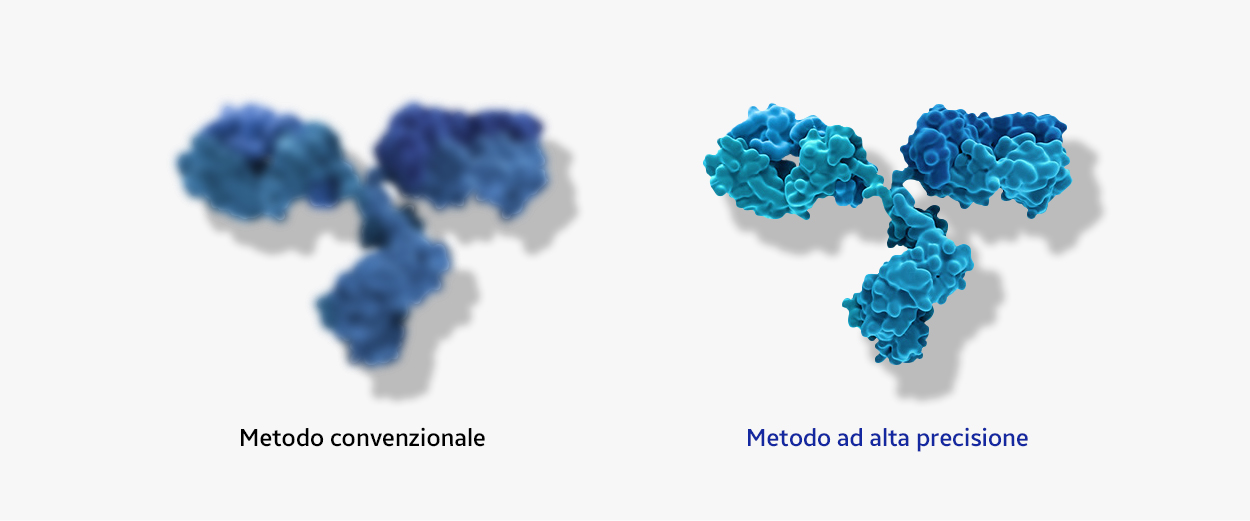
Sistema Tollgate
Tollgate è un sistema di controllo della qualità che ci permette di valutare se gli obiettivi di qualità sono stati raggiunti a ogni punto nodale. Solo le molecole di qualità più elevata che raggiungono gli standard qualitativi possono passare alla fase successiva del processo di produzione su larga scala.
- 1. Cell line selection and optimization
- 2. Lab scale
- 3. Pilot scale
- 4. Production scale
Characterization + Stability study